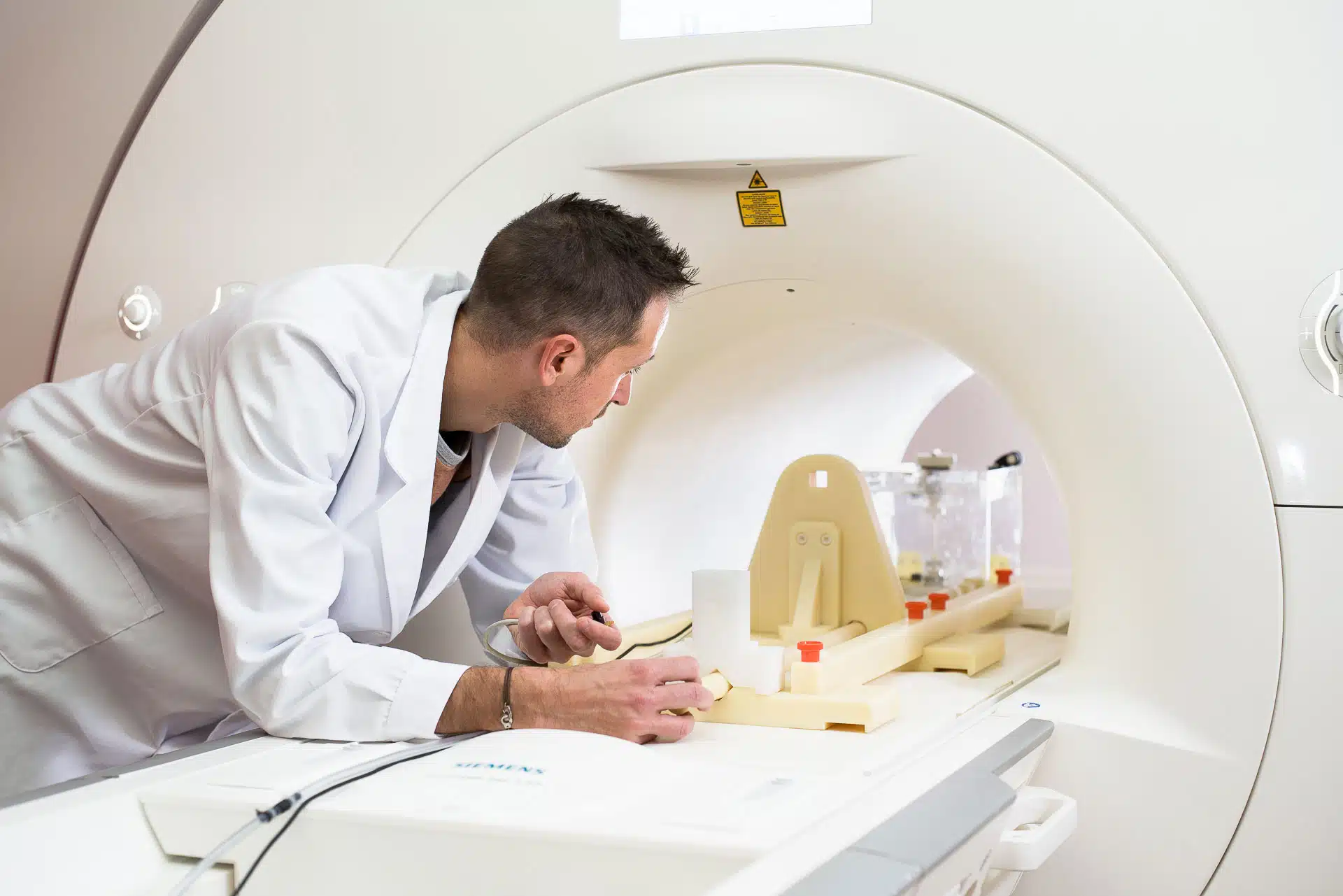
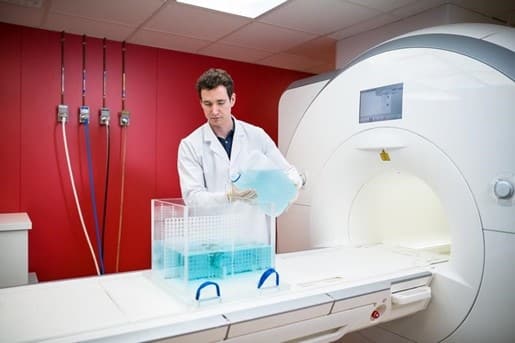
En imagerie médicale, les altérations des images sont appelées des artefacts. En IRM, la présence d’un dispositif contenant des matériaux ferromagnétiques, paramagnétiques ou conducteurs entraîne systématiquement la formation d’artefacts.
Ceux-ci se manifestent généralement par des zones de signal nul (noires) autour du dispositif, voire par des distorsions de l’image.
Dans la majorité des cas, la présence d’un artefact n’induit pas de risque majeur, mais il peut masquer des structures anatomiques importantes et altérer l’interprétation diagnostique.
Voyons ensemble comment ces artefacts sont évalués sur les implants.
Comment réaliser l’évaluation des artefacts ?
Pour des dispositifs passifs implantés, la norme ASTM F2119 définit une méthode d’évaluation des artefacts. Cette norme est citée dans de nombreuses autres normes, notamment la norme ISO10974 et le guide FDA « Testing and Labeling Medical Devices for Safety in the Magnetic Resonance (MR) Environment »qui la définissent comme une méthode possible pour évaluer les artefacts sur un implants actif.
Les artefacts sont donc évalués par un essai, nous réalisons des images en présence du dispositif, selon un protocole défini par la norme ASTM F2119, sur des systèmes IRM à 1,5 T et/ou 3 T. Ces images sont ensuite comparées à des images de référence, sans dispositif, pour évaluer l’étendue des artefacts provoqué par sa présence.
Les artefacts sont généralement évalués à chacun des champs magnétiques pour lesquels une condition d’IRM est revendiquée dans le marquage du dispositif, le plus souvent à 1,5 T et 3 T.
HEALTIS est accréditée suivant la norme NF EN ISO/CEI 17025 pour réaliser des essais selon la norme ASTM F2119 (Accréditation Cofrac Essais, N° 1-6320, portée disponible sur www.cofrac.fr).
“Worst-Case” pour l’essai d’artefact : comment le définir ?
La norme ASTM F2119 n’exige pas d’évaluer l’artefact spécifiquement sur la configuration générant le pire artefact.
En revanche, le guide FDA « Testing and Labeling Medical Devices for Safety in the Magnetic Resonance (MR) Environment » nous indique que le plus grand dispositif médical ou le dispositif médical comportant la plus grande quantité de matériau magnétique peut généralement servir de configuration « worst-case ».
Comment interpréter les résultats de test ?
Comme indiqué dans les recommandations de la FDA, il n’existe généralement pas de critères d’acceptation pour les artefacts d’image. L’objectif de cette évaluation est de fournir, dans le marquage du dispositif, des informations utiles aux professionnels de santé afin qu’ils puissent apprécier le rapport bénéfice-risque d’un examen IRM pour un patient porteur du dispositif.
Nous sommes là pour vous épauler
Chez Healtis, nous vous accompagnons à chaque étape de votre étude, qu’il s’agisse de l’évaluation des artefacts en IRM ou de l’évaluation de l’ensemble des risques liés à l’introduction de votre dispositif médical en IRM.
Des questions pour votre projet ? N’hésitez pas à nous contacter dès maintenant, via notre page contact ou à l’adresse [email protected].